دشمنِ سرسختِ قدیمی، دوست قدرتمندِ فعلی
چگونه شناخت ساختار هپاتیت C منجر به کشف داروهای ضد ویروسی با اثر مستقیم شد؟
حتما تا بهحال شنیدهاید که با مبارزه دشمنانی که شناخته شدهاند آسانتر است. کشف ویروس هپاتیت C در سال 1989 نمونه کاملی از چگونگی تبدیل دانش علمی به موفقیت بالینی است. قبل از آن انتقال خون، ریسک قابل توجهی برای ابتلا به بیماریهای مزمنی همچون هپاتیت داشت زیرا هپاتیت میتواند باعث آسیب شدید کبدی و سرطان شود. اما با کشف عاملِ بیماریزایی اکنون نمونه خون اهدا شده را برای بررسی وجود ویروس، غربالگری میکنند. همچنین در حال حاضر روشهای درمانیِ جدیدی برای مبارزه با این ویروس کشف شده است و برای اولین بار این امکان وجود دارد که یک عفونت مزمن با دارو درمان شود. این موفقیت چشمگیر حاصل تحقیقات H. J. Alter، M. Houghton و C. M. Rice بود که در سال 2020 جایزه نوبل فیزیولوژی یا پزشکی را دریافت کردند.
آشنایی با ویروس HCV
ویروس هپاتیت C به دلیل تأثیر آن بر سلامت عمومی جامعه و ارتباط آن با بیماریهای جدیِ کبدی یک نگرانی مهم برای سلامتی در سطح جهانی است. HCV ویروسی است که بهوسیله خون منتقل شده که عمدتاً کبد را هدف قرار داده و منجر به ایجاد هپاتیت حاد و مزمن میشود. عفونت مزمن HCV یکی از علل اصلی اختلال در گردش خون کبدی، نارسایی کبد و کارسینوم سلولهای کبدی (سرطان کبد) است که باعث عوارض جانبی و مرگومیر قابل توجهی در سراسر جهان میشود.
بیماریهای ایجاد شده توسط HCV
هپاتیت حاد: عفونت اولیه HCV میتواند منجر به هپاتیت حاد شود که با علائمی مانند زردی، خستگی و علائم شبیه آنفولانزا خود را نشان میدهد.
هپاتیت مزمن: تقریباً 70 تا 85 درصد از افراد مبتلا، به هپاتیت مزمن مبتلا میشوند که ممکن است برای سالها بدون علامت باشد اما در طول زمان میتواند منجر به آسیب شدید کبدی شود.
سیروز کبدی: عفونت مزمن HCV یکی از علل اصلی ایجاد سیروز کبدی است، این وضعیت با زخم شدن کبد و از دست رفتن عملکرد آن مشخص میشود.
کارسینوم کبدی: HCV یکی از عوامل اصلی در ابتلا به سرطان کبد است، یک سرطان اولیهی کبد که میتواند پس از سالها عفونت مزمن و آسیب کبدی ایجاد شود.
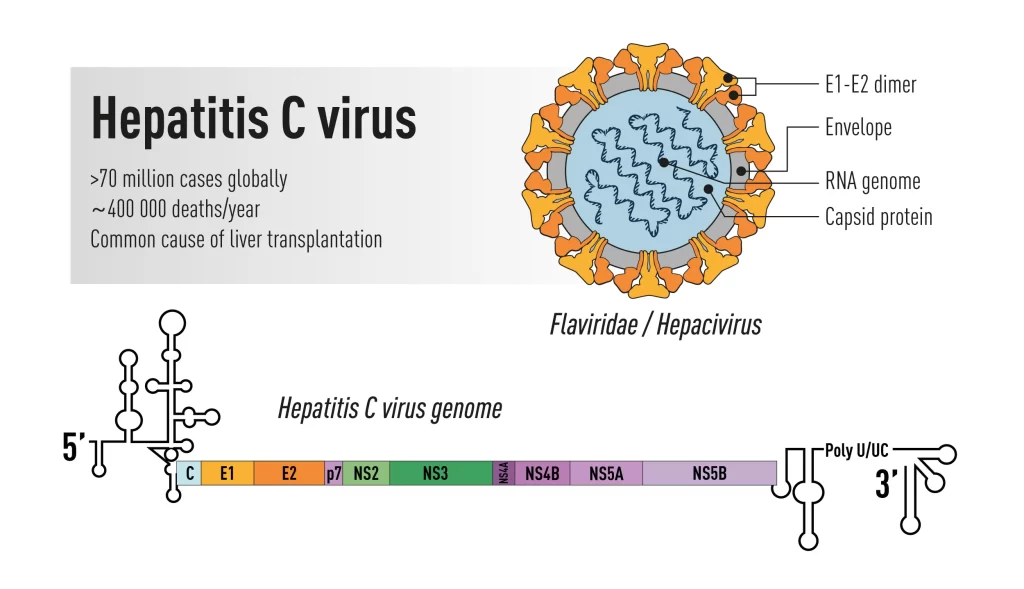
اهمیت درک ساختار HCV
با درک ساختار مولکولی و عملکرد HCV و پروتئینهای مرتبط با آن محققان و متخصصان میتوانند راههای بهتری برای درمان، پیشگیری و در نهایت ریشه کنکردن ویروس پیدا کنند. درک ساختار با مطالعه ویروس در سه حوزه ذیل صورت میگیرد:
توسعه واکسن: بینش ساختاری در مورد HCV همچنین میتواند به توسعه واکسنهای موثر برای جلوگیری از عفونت HCV کمک کند.
چرخه حیات ویروس HCV: درک ساختار HCV برای روشن کردن چرخه زندگی آن، از جمله ورود به سلولهای میزبان، تکثیر و تولید ذرات ویروسی جدید ضروری است.
توسعه دارو: آگاهی از اجزای ساختاری ویروس مانند پروتئاز/هلیکاز و سایر پروتئینهای آن به طراحی داروهای ضد ویروسی هدفمند کمک میکند.
ساختار پروتئین NS3
پروتئین NS3، جزء حیاتی ویروس هپاتیت C است. NS3، یک پروتئین غیر ساختاری است که حاصل برش 70 کیلو دالتون از پلیپروتئین در HCV است. ساختار پروتئین NS3 از دو بخش مجزا تشکیل شده است؛ دامنه N ترمینال با فعالیت پروتئازی و دامنه C ترمینال با فعالیت هلیکازی. این دو دامنه توسط یک ناحیه پیوند دهنده منعطف به هم متصل میشوند. پروتئین NS3 از این نظر منحصر به فرد است که دو عملکرد متمایز را، فعالیتهای پروتئازی و هلیکازی، در یک ساختار پروتئینی واحد انجام میدهد.
ساختار پروتئازی و هلیکازی در پروتئین NS3
- بخش پروتئاز
یک سرین پروتئاز است که در N ترمینال قرار دارد وهمراه با کوفاکتور آن NS4A که برای حداکثر عملکرد پروتئاز مورد نیاز است و نیز کمپلکس را به غشای سلولی متصل میکند، در پردازش پلیپروتئین ویروسی نقش دارد. پلیپروتئین، یک مولکول پیشساز است که برای تولید پروتئینهای منفرد مورد نیازبرای تکثیر ویروسی شکسته میشود. دامنه پروتئاز حاوی سه بخش کاتالیزوری شامل هیستیدین، آسپارتات و باقی ماندههای سرین است که برای فعالیت آنزیمی آن ضروری است. فعالیت پروتئاز برای چرخه زندگی ویروس ضروری است، چون پلیپروتئینی را که از RNA ویروسی به پروتئینهای فعال و منفرد تبدیل میشود را پردازش میکند.
این بخش در واقع یک RNA هلیکاز وابسته به ATP است که در دو سوم C ترمینال در پروتئین NS3 قرار گرفته است. در طی تکثیر ویروس، هلیکاز دو رشتهی RNA تولید شده را باز کرده و به آنزیم RNA پلیمراز ویروسی اجازه میدهد تا به رشته RNA الگو دسترسی پیدا کرده و ژنومهای ویروسی جدید را سنتز کند. این عملکرد برای تکثیر ژنوم ویروسی و تشکیل ذرات ویروس جدید ضروری است.
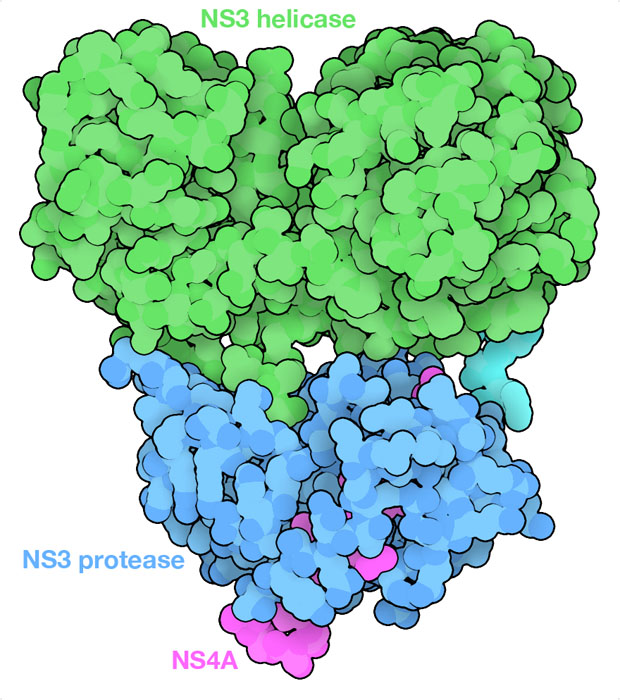
- بخش هلیکاز
این بخش در واقع یک RNA هلیکاز وابسته به ATP است که در دو سوم C ترمینال در پروتئین NS3 قرار گرفته است. در طی تکثیر ویروس، هلیکاز دو رشتهی RNA تولید شده را باز کرده و به آنزیم RNA پلیمراز ویروسی اجازه میدهد تا به رشته RNA الگو دسترسی پیدا کرده و ژنومهای ویروسی جدید را سنتز کند. این عملکرد برای تکثیر ژنوم ویروسی و تشکیل ذرات ویروس جدید ضروری است.
وظایف و فعالیتهای پروتئین NS3
- همکاری در همانندسازی
ترکیبی از فعالیتهای پروتئازی و هلیکازی موجود در NS3 به پروتئین این اجازه را میدهد تا پردازش پلیپروتئینهای ویروسی و باز شدن دو رشتهی RNA را در طول فرآیند همانندسازی هماهنگ کند.
- پیوند عملکردی(Functional Linkage)
فعالیتهای پروتئازی و هلیکازی از طریق ناحیه پیوند دهندهی انعطاف پذیر صورت میگیرد. این نوع از آرایش ساختاری به پروتئین اجازه میدهد تا نقشهای دوگانه خود را به طور موثر انجام داده و از پیشرفت مناسب چرخه حیات ویروسی اطمینان حاصل کند.
جهش و مقاومت در ویروس هپاتیت HCV
جهش در پروتئاز و هلیکاز ویروس هپاتیت HCV میتواند تأثیر قابل توجهی بر مقاومت دارویی و نتایج درمان داشته باشد. با تکثیر ویروس، تغییراتی در توالی ژنتیکی آن ممکن است ایجاد شود که به طور بالقوه ساختار و عملکرد آنزیمهای پروتئاز و هلیکاز را تغییر میدهد. این جهشها میتوانند بر حساسیت ویروس به داروهای ضد ویروسی، به ویژه ضد ویروسهای مستقیماثر (DAA) که این آنزیمها را هدف قرار میدهند، تأثیر بگذارند.
چگونه داستان روزالیند فرانکلین بازنویسی شد!
جهشهای شناخته شده در پروتئاز و هلیکاز HCV
- جهش در دامنه پروتئاز NS3، به ویژه در داخل و اطراف جایگاه فعال میتواند بر اتصال مهارکنندههای پروتئاز تأثیر گذاشته و منجر به کاهش اثربخشی دارو شده و به مقاومت کمک کنند. به عنوان مثال، داروهای جایگزین متداول مرتبط با مقاومت (RAS) در پروتئاز NS3 شامل V36M، T54A و R155K است. این جهشها میتوانند اثربخشی مهارکنندههای پروتئاز مانند Simeprevir را کاهش دهند.
- در حالی که مهارکنندههای هلیکاز کمتر تجویز میشوند، جهش در این بخش نیز میتواند بر کارایی دارو تأثیر بگذارد. تغییرات در محل اتصال ATP یا محل اتصال به RNA میتواند منجر به مقاومت شود.
نحوه اثر مقاومت دارویی
- میل اتصال: جهش در حوزه پروتئاز یا هلیکاز ممکن است میلِ اتصال مهارکنندهها را تغییر داده و توانایی آنها را برای مهار موثر فعالیت آنزیم کاهش دهد.
- مقاومت متقاطع: برخی جهشها ممکن است به چندین دارو در یک کلاس یا حتی در کلاسهای مختلف DAA مقاومت ایجاد کند و درمان را چالش برانگیزتر کند.
استفاده از مهارکنندههای پروتئاز و هلیکاز در تولید داروها
از مهارکنندههای پروتئاز و هلیکاز ویروس HCV برای هدف قرار دادن جایگاههای فعال این آنزیمها، مختل کردن عملکرد آنها و در نتیجه مهار چرخه حیات ویروسی طراحی استفاده میشود. این مهارکنندهها نقش مهمی در درمان عفونت ناشی از HCV دارند و نیز احتمال بهبود بیماری را افزایش میدهد.
- مهارکنندههای پروتئاز
مهارکنندههای پروتئاز به جایگاه فعال پروتئاز NS3 که حاوی یک سه گانه کاتالیزوری (بقایای هیستیدین، آسپارتات و سرین) است، متصل میشوند. این برهمکنش پروتئاز را از پردازش پلیپروتئین ویروسی بازداشته و در نتیجه تولید پروتئینهای غیرساختاری لازم برای تکثیر ویروس را مهار میکند. مهارکنندههای پروتئاز کارایی بالایی در کاهش بار ویروسی و بهبود نرخ پاسخ ویروسی پایدار (SVR) در بیماران مبتلا به عفونت HCV نشان دادهاند. آنها اغلب به عنوان بخشی از درمانهای ترکیبی برای پیشرفت درمان استفاده میشوند.
به عنوان مثال چندین مهارکنندهی پروتئاز برای درمان HCV، از جمله Simeprevir، Paritaprevir و Grazoprevir، تایید شدهاند. این مهارکنندهها درجات مختلفی از اثرگذاری را بر ژنوتیپهای مختلف HCV نشان میدهند.
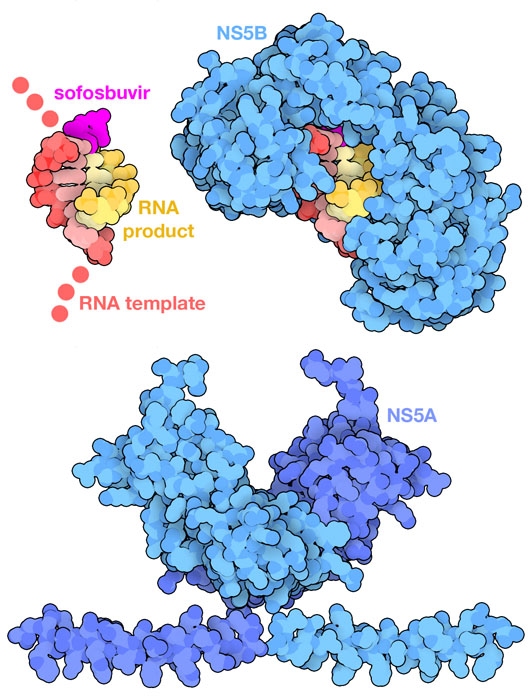
- مهارکنندههای هلیکاز
مکانیسم عمل مهارکنندههای هلیکاز به این صورت است که هلیکاز جایگاههای فعال NS3 را هدف قرار میدهد یا با اتصال به محل اتصال ATP یا محل اتصال به RNA، این مانع از باز شدن و تکثیر رشتههای RNA ویروسی میشود.
در حال حاضر مهارکنندههای پروتئازی کاربرد بالینی گستردهای دارند در حالی که مهارکنندههای هلیکازی هنوز تا حد زیادی در مراحل آزمایش و توسعه هستند. این به این دلیل است که در طراحی مهارکنندههای موثر بر روی هلیکاز به دلیل پیچیدگی عملکرد آنزیم و ریسک اثرات پیش بینی نشده، چالشهایی را ایجاد می کند.
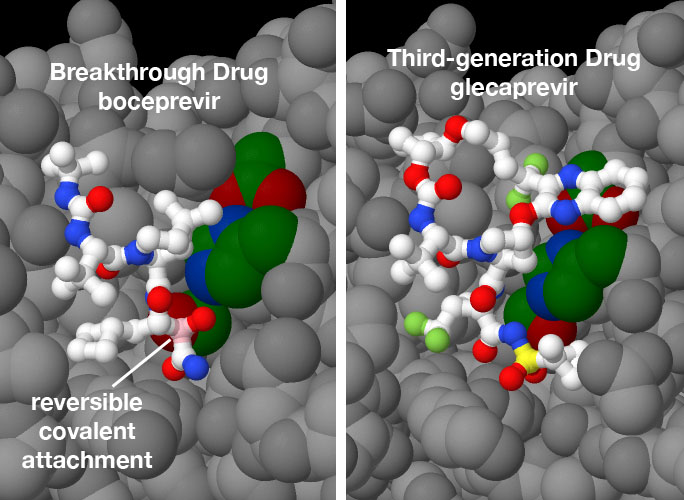
تهدف گرفتن جایگاه فعال پروتئاز در HCV دشوار است زیرا مانند بسیاری از جایگاه فعال آنزیمی دیگر جایگاههای اتصالشان عمیق نیست. از این رو شیمیدانان دارویی به دو روش بر این چالش غلبه کردهاند. آنتی ویروسهای نسل اول boceprevir و telaprevir یک پیوند کووالانسی برگشت پذیر با جایگاه فعال آمینواسیدِ سرین تشکیل داده و باعث میشود تا دارو روی سطح آنزیم قفل شود. علیرغم عملکرد خوب این داروها عوارض جانبی ناخواستهای دارند. داروهای نسل بعدی مانند grazoprevir، glecaprevir و voxilaprevir که اکنون بهصورت گسترده استفاده میشومد، ساختار حلقوی بزرگی دارند که سطح پروتئین را در بر میگیرد.
درمان ترکیبی
1. اثرات سینرژیسم(همافزایی): مهارکنندههای پروتئاز اغلب در ترکیب با سایر داروهای ضد ویروسی مانند مهارکنندههای NS5A و آنالوگهای نوکلئوزیدی، برای افزایش کارایی درمان و کاهش خطر مقاومت دارویی استفاده میشوند.
2. داروهای ضد ویروسی با اثر مستقیم (DAAs): توسعه ضد ویروسهایی با اثر مستقیم که مراحل مختلف چرخه زندگی HCV، از جمله پروتئاز و هلیکاز را هدف قرار میدهند، درمان HCV را متحول کرده و با افزایش نرخ درمان بههمراه عوارض جانبی کمتر همراه بوده است.
3. درمان براساس ویژگیهای ویروس مورد نظر: درمانهای ترکیبی ممکن است برای بیماران بر اساس ژنوتیپ و زیرگروه HCV طراحی شود و احتمال موفقیت درمان را به حداکثر برساند.
نگاهی به مسیر تحقیقاتِ آینده
هدف تحقیقات آینده، کشف اهداف دارویی جدید در ساختارHCV، مانند فاکتورهای میزبان و تداخلات پروتئینهای ویروسی است. پیشرفتها در طراحی مهار کنندهها، از جمله مهارکنندههای دوگانه که هم فعالیتهای پروتئاز و هم هلیکاز را هدف قرار میدهند، منجر به ارائه استراتژیهای درمانی امیدوارکنندهای میشوند. علاوه بر این، تعدیلکنندههای(مدولاتورهای) آلوستریک که یخشهایی غیر از جایگاه فعال را هدف قرار میدهند، یک رویکرد جایگزین برای توسعه دارو را ارائه میدهند.
و در آخر….
زیستشناسی ساختاری پروتئاز و هلیکاز در ویروس هپاتیت C بینشهای مهمی را برای توسعه درمانهای ضد ویروسی هدفمند ارائه میدهد. تحقیقات و پیشرفتهای در حال انجام جهت طراحی مهارکنندهها و درمانهای ترکیبی، امید به درمانهای مؤثرتر و ریشهکنی عفونت HCV را فراهم میکند.
منبع: PDB

